Schritt-für-Schritt Anleitung 1
Welche Masse an Kohlenstoffdioxid entsteht bei der Verbrennung von 2 kg Kohlenstoff?
Schritt 1
Stelle zuerst die zugehörige Reaktionsgleichung auf.
Schritt 2
Reaktionsgleichung: C + O2 → CO2
Du weißt, dass eine Kohlenstoffportion der Masse m = 2 kg verbrannt wird.
Berechne nun welcher Stoffmenge n dies entspricht. Dazu brauchst du die Formel m = M · n.
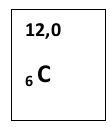
Schritt 3
Es ist M(C) = 12 g/mol und
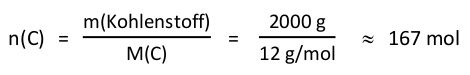
Bestimme nun mithilfe der Reaktionsgleichung die zugehörige Stoffmenge an Kohlenstoffdioxid.
Schritt 4
Die Reaktionsgleichung (C + O2 → CO2) sagt aus, dass bei einem Einsatz von
167 mol Kohlenstoff auch 167 mol Kohlenstoffdioxid entstehen, also
n(CO2) = 167 mol
Berechne nun die zugehörige Masse an Kohlenstoffdioxid. Dazu brauchst du wieder die Formel m = M · n.
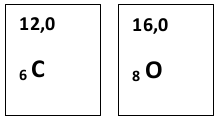
Lösung
Es ist M(CO2) = 44 g/mol und
m(Kohlenstoffdioxidportion) = n(CO2) · M(CO2) = 167 mol · 44 g/mol = 7348 g
Bei der Verbrennung von 2kg Kohlenstoff entstehen also über 7kg Kohlenstoffdioxid.
Schritt-für-Schritt Anleitung 1: Herunterladen [docx][29 KB]
Schritt-für-Schritt Anleitung 1: Herunterladen [pdf][314 KB]
Weiter zu Schritt-für-Schritt Anleitung 2
