Lewis-Schreibweise
Lösung
Lewis-Modell: Darstellung der bindenden und freien Elektronenpaare unter Einhaltung der Oktettregel.
Lewis-Schreibweise: Elektronen (e-) werden als Punkt und e--Paare werden als Strich gekennzeichnet.
Beispiel: Chlormolekül
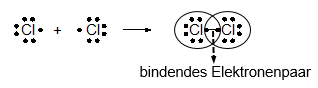
bindendes Elektronenpaar
Lewis-Schreibweise:
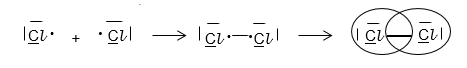
Gib die Lewis-Formel für Kohlenstoffdioxid (CO 2 ) an.
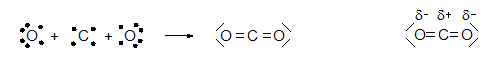
Es gibt Atome, die das bindende Elektronenpaar stärker anziehen können. Durch die ungleichmäßige Verteilung im Molekül erhalten sie eine negative Teilladung. In der folgenden Reihe nimmt die Stärke zu:
![]()
Übung
:
Gib die Lewis-Formeln für folgende Verbindungen an und kennzeichne die Ladungsschwer-punkte.
-
HCl
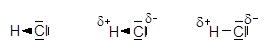
-
O
2
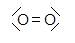
-
H
2
O
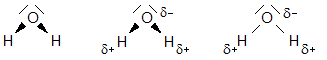
-
N
2
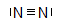
-
H
2
S
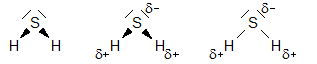
-
NH
3
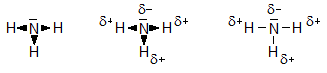
-
H
2
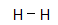
lewis-schreibweise_uebungsblatt:
Herunterladen
[pdf][179 KB]
lewis-schreibweise_uebungsblatt_loesung:
Herunterladen
[docx][94 KB]
