Van der Waals-Kräfte Arbeitsblatt
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
Van-der-Waals-Kräfte
Alle Moleküle, auch die unpolaren, üben Anziehungskräfte aufeinander aus. Diese bin-denden Kräfte nennt man Van-der-Waals-Kräfte (nach ihrem Entdecker, dem holländi-schen Physiker van der Waals, 1837-1923).
Die Kräfte, mit denen sich die Moleküle gegenseitig anziehen, sind im Allgemeinen schwach. Sie haben auch nur eine sehr geringe Reichweite. Deshalb wirken sie nur an Stellen, wo sich die Moleküle ganz nahe kommen. Je größer die Moleküle - und damit auch ihre Oberfläche - desto mehr „Haftstellen“ sind vorhanden. Deshalb sind innerhalb der homologen Reihe die Van-der-Waals-Kräfte umso stärker, je größer die Moleküle sind.
|
Mit zunehmender Molekülgröße werden die ________________________-Kräfte ________________. Zwischen _______________ Molekülen sind ____________________ Anziehungskräfte wirksam als zwischen _______________ Molekülen. |
Die Van-der-Waals-Kräfte sind zwar nur schwach, sie haben aber große Auswirkungen auf die physikalischen Eigenschaften der Alkane.
Siedetemperatur/Flüchtigkeit
Um einen Stoff zum Sieden zu bringen, muss man die einzelnen Moleküle voneinander trennen. Das kostet Energie, da zwischen den Molekülen Anziehungskräfte herrschen, die erst überwunden werden müssen.
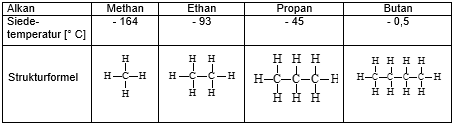
- Zeichnet in der folgenden Abbildung 1 die Van-der-Waals-Kräfte mit grüner Farbe ein. Bei welchen Molekülen könnt ihr mehr Van-der-Waals-Kräfte einzeichnen?
- Macht eine Aussage zum Zusammenhang zwischen der Stärke der Van-der-Waals-Kräfte und der Siedetemperatur (bei welchen Molekülen muss mehr Energie aufgewendet werden, um sie voneinander zu trennen?)
Abbildung 1: Van-der-Waals-Kräfte und Siedetemperatur
Löslichkeit
Es gilt: Gleiches löst sich in Gleichem, d. h. unpolare Stoffe lösen sich in unpolaren, polare Stoffe lösen sich in polaren.
Auch hier spielen die Anziehungskräfte zwischen den Molekülen eine große Rolle. Löst man einen Stoff in einem Lösungsmittel, so muss der Stoff stark genug sein, die An-ziehungskräfte zwischen den Lösungsmittelmolekülen aufzubrechen, damit er sich zwischen die Lösungsmittelmoleküle drängen kann. Damit dieser Zustand der Lösung bestehen bleibt, müssen sich neue Anziehungskräfte zwischen Stoff- und Lösungsmittel-Molekülen bilden können. Diese Anziehungskräfte können nur ausgebildet werden, wenn die Moleküle ähnlich sind (beide polar oder beide unpolar).
Abbildung 2: Lösungsvorgang von Zucker in Wasser
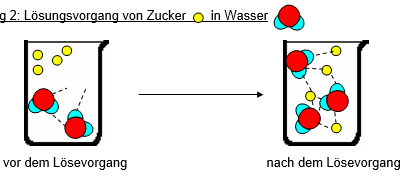
vor dem Lösevorgang nach dem Lösevorgang
Es sind nicht alle Anziehungskräfte gleich stark:
|
Stärke
schwach stark sehr stark |
|
Anziehungskraft
|
- Vergleicht die beiden Bilder in Abbildung 2. Was hat sich beim Lösen des Zuckers verändert?
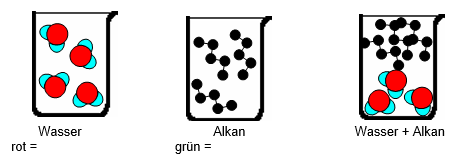
- Welche Anziehungskräfte herrschen zwischen Wassermolekülen? Zeichnet sie in der Abbildung 3 rot ein.
- Welche Wechselwirkungen herrschen zwischen Alkanmolekülen? Zeichnet sie in der Abbildung 3 grün ein.
- Wieso lösen sich Alkane nicht in Wasser?
- Begründet, ob Hexan sich in Decan lösen kann.
Abbildung 3: Anziehungskräfte und Löslichkeit
van_der_waals-kraefte_arbeitsblatt:
Herunterladen
[pdf][97 KB]
van_der_waals-kraefte_arbeitsblatt:
Herunterladen
[docx][40 KB]