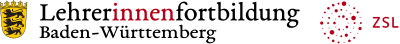Alkansäuren
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
Physik. und chemische Eigenschaften von Alkansäuren
Gruppenarbeit
Gruppe 1: Siedetemperaturen von Alkansäuren
Löst die gestellten Aufgaben in eurer Gruppe. Ihr habt dafür 20 Minuten Zeit. Tragt die Ergebnisse in die Folie ein. Wählt einen Gruppensprecher für die Präsentation eurer Ergebnisse.
Aufgaben:
- Beschreibt die im Diagramm dargestellte Abhängigkeit der Siedetemperaturen von der Länge der Kohlenstoffkette. Begründet den Zusammenhang.
-
Vergleicht die Siedetemperaturen der Alkanole und Alkansäuren gleicher Kettenlänge.
- Welche Schlussfolgerung könnt ihr ziehen?
-
Erklärt diesen Zusammenhang.
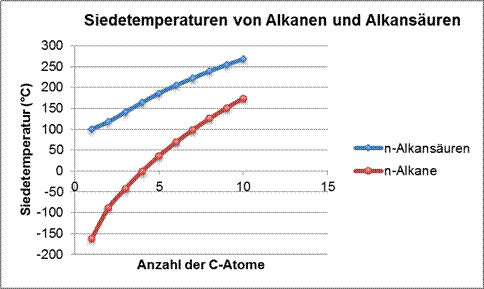
Folgende Leitragen könnt ihr dabei zu Hilfe nehmen:- Zeichnet zwei Ethanol-Moleküle und zwei Ethansäuremoleküle.
- Gebt die Teilladungen der funktionellen Gruppen an.
- Welche Anziehungskräfte bestehen zwischen den Ethanol-Molekülen bzw. zwischen den Ethansäuremolekülen?
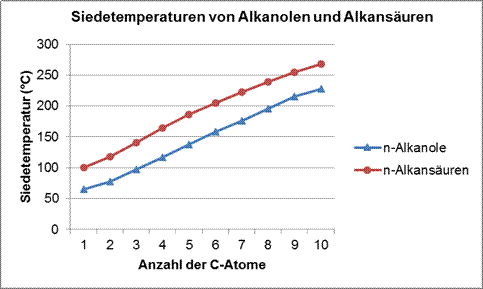
Alternativ können hier auch die Siedetemperaturen der n-Alkansäuren mit denen der n-Alkane verglichen werden:
Gruppenarbeit
physikalische und chemische Eigenschaften von Alkansäuren
Gruppe 2: Löslichkeit von Alkansäuren
Führt die folgenden Versuche durch und löst die gestellten Aufgaben in eurer Gruppe. Ihr habt dafür 20 Minuten Zeit. Tragt die Ergebnisse in die Folie ein. Wählt einen Gruppensprecher für die Präsentation eurer Ergebnisse.
Versuch:
|
Geräte
|
Chemikalien
|
Sicherheit:


Durchführung:
Füllt je 4 Reagenzgläser mit ca. 5 mL dest. Wasser bzw. Benzin. Gebt von jeder Alkansäure 1 mL mit der Einmalpipette bzw. eine Spatelspitze in ein mit Wasser bzw. Benzin gefülltes Reagenzglas und schüttelt das Reagenzglas vorsichtig zum Durchmischen der Proben. Erwärmt die Probe mit Palmitinsäure etwas in eurer Hand.
Aufgaben:
- Notiert eure Beobachtungen in einer Tabelle.
- Leitet aus eurer Beobachtung eine Regel für die Benzin- bzw. Wasserlöslichkeit der Alkansäuren in Abhängigkeit von der Länge der C-Kette ab.
- Gebt die Strukturformeln der Ethansäure und Pentansäure an. Markiert in den Molekülstrukturen die polaren bzw. die unpolaren Molekülanteile.
- Erklärt das Löslichkeitsverhalten der Alkansäuren in Wasser bzw. Benzin.
Gruppenarbeit
physikalische und chemische Eigenschaften von Alkansäuren
Gruppe 3: Leitfähigkeit von Alkansäuren
Führt den folgenden Versuch unter dem Abzug durch und löst die gestellten Aufgaben in eurer Gruppe. Ihr habt dafür 20 Minuten Zeit. Tragt die Ergebnisse in die Folie ein. Wählt einen Gruppensprecher für die Präsentation eurer Ergebnisse.
Versuch:
|
Geräte
|
Chemikalien
|
Sicherheit



Durchführung:
- Gebt 80 mL dest. Wasser in ein Becherglas. Haltet den Leitfähigkeitsprüfer in das dest. Wasser und notiert eure Beobachtung. Trocknet den Prüfer vorsichtig mit einem Papiertuch ab.
- Eure Lehrerin/euer Lehrer füllt euch nun 20 mL konzentrierte Essigsäure in ein weiteres Becherglas. Prüft auch hier die Leitfähigkeit und notiert eure Beobachtung.
- Gebt nun langsam dest. Wasser zu der Essigsäure. Prüft die Leitfähigkeit während der Zugabe und notiert eure Beobachtungen während des Verdünnungsvorgangs.
Achtung: Spült den Leitfähigkeitsprüfer nach der Messung gründlich über dem dritten Becherglas mit dest. Wasser ab und trocknet ihn vorsichtig ab.
Aufgabe:
Begründet eure Beobachtungen. Folgende Impulse können euch dabei helfen:
- Welche Voraussetzung muss eine Lösung erfüllen, damit sie den elektrischen Strom leitet?
-
Beim Verdünnen der Essigsäure läuft folgende Reaktion ab:
 + H2O
+ H2O

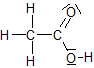 + H3O+
+ H3O+
Gruppenarbeit
physikalische und chemische Eigenschaften von Alkansäuren
Gruppe 4: Alkansäuren reagieren sauer
Führt den folgenden Versuch durch und löst die gestellten Aufgaben in eurer Gruppe. Ihr habt dafür 20 Minuten Zeit. Tragt die Ergebnisse in die Folie ein. Wählt einen Gruppensprecher für die Präsentation eurer Ergebnisse.
Versuch:
|
Geräte
|
Chemikalien
|
Durchführung:
- Gebt ca. 1 cm der zu untersuchenden Lebensmittel (bei Joghurt nehmt ihr den flüssigen Überstand) in je ein Reagenzglas. Tropft je 2 Tropfen Universalindikator dazu.
- Beobachtet die Färbung des Indikators und bestimmt mit Hilfe der Farbskala den pH-Wert. Tragt eure Werte in die Tabelle ein (siehe Ergebnisfolie).
Aufgaben:
- Welche Aussagen über die Lebensmittel könnt ihr aufgrund des pH-Wertes treffen?
- Überlegt, welche drei Säuren in den drei Lebensmitteln für den ermittelten pH-Wert verantwortlich sind. Sucht auf dem Lehrerpult die passenden Säuren heraus und stellt die dazugehörigen Lebensmittel daneben (ihr könnt dafür auch euer Chemiebuch zu Hilfe nehmen).
-
Damit eine Lösung sauer reagiert, müssen „saure Teilchen“, die H3O+-Ionen in der Lösung vorhanden sein.
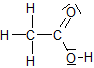
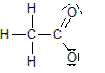
![]() + H2O + H3O+
+ H2O + H3O+
- Benennt in der obigen Reaktionsgleichung die Säure und markiert das Teilchen in der Säure, das für die saure Reaktion verantwortlich ist.
- Erklärt die Bildung der H3O+-Ionen in einer wässrigen Ethansäurelösung mit Hilfe der Reaktionsgleichung.
Zusammenfassung physikalische und chemische Eigenschaften von Alkansäuren
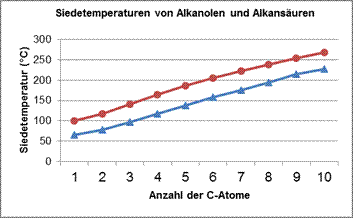
Siedetemperaturen der Alkansäuren
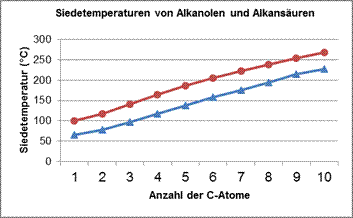
![]()
Zusammenhang zwischen der Siedetemperatur und der C-Kettenlänge bei Alkansäuren:
________________________________________________________________________
Erklärung:________________________________________________________________________________________________________________________________________
Erklärung für den Unterschied in der Siedetemperatur zwischen Alkanolen und Alkansäuren gleicher C-Kettenlänge:
________________________________________________________________________________________________________________________________________________________________________________________________________________________
Löslichkeit der Alkansäuren
Regel für die Löslichkeit der Alkansäuren in Benzin und Wasser:
________________________________________________________________________________________________________________________________________________
Erklärung für die Löslichkeit:
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Leitfähigkeit der Alkansäuren
Elektrische Leitfähigkeit von dest. Wasser:______________________________________
Elektrische Leitfähigkeit von konz. Essigsäure:___________________________________
Elektrische Leitfähigkeit der wässrigen Essigsäurelösung:__________________________
Eine Lösung leitet den elektrischen Strom, wenn ________________________________.
Beim Verdünnen der Essigsäure läuft folgende Reaktion ab:
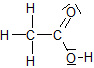
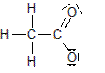
![]() + H2O + H3O+
+ H2O + H3O+
Erklärung für die beobachtete elektrische Leitfähigkeit der konz. Essigsäure und der wässrigen Essigsäurelösung:
________________________________________________________________________________________________________________________________________________________________________________________________________________________
Die saure Reaktion
|
Speiseessig |
Zitronensaft |
Joghurt |
Leitungswasser |
|
|
pH-Wert |
||||
|
enthaltene Säure |
Damit eine Lösung sauer reagiert, müssen „saure Teilchen“, die H3O+-Ionen in der Lösung vorhanden sein.
Reaktionsgleichung: siehe oben
Erklärung:
________________________________________________________________________________________________________________________________________________________________________________________________________________________
Zusammenfassung - Lösung physikalische und chemische Eigenschaften von Alkansäuren
Siedetemperaturen der Alkansäuren
![]()
Zusammenhang zwischen der Siedetemperatur und der C-Kettenlänge bei Alkansäuren:
Je länger die C-Kette, umso höher die Sdt.
Erklärung:
mit zunehmender Kettenlänge nehmen auch die Anziehungskräfte (hier: Van-der-Waals-Kräfte) zwischen den Molekülen zu.
Erklärung für den Unterschied in der Siedetemperatur zwischen Alkanolen und Alkansäuren gleicher C-Kettenlänge:
Zwischen Alkansäuremolekülen herrschen stärkere Anziehungskräfte als zwischen Alkanol-Molekülen der gleichen Kettenlänge (bei Alkansäuren kommen zusätzlich zu den H-Brücken ausgehend von den OH-Gruppen auch noch Dipol-Dipol-Wechselwirkungen zum Tragen).
Löslichkeit der Alkansäuren
Regel für die Löslichkeit der Alkansäuren in Benzin und Wasser:
Je länger die Kette, umso schlechter löst sich die Alkansäure in Wasser, umso besser löst sie sich in Benzin.
Erklärung für die Löslichkeit:
Mit zunehmender Kettenlänge nimmt der Einfluss der lipophilen C-Kette zu, der Einfluss der hydrophilen Carboxylgruppe nimmt ab.
Leitfähigkeit der Alkansäuren
Elektrische Leitfähigkeit von dest. Wasser:
leitet nicht
Elektrische Leitfähigkeit von konz. Essigsäure:
leitet nicht
Elektrische Leitfähigkeit der wässrigen Essigsäurelösung:
leitet
Eine Lösung leitet den elektrischen Strom, wenn
bewegliche geladene Teilchen vorhanden sind.
Beim Verdünnen der Essigsäure läuft folgende Reaktion ab:
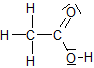
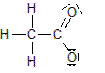
![]() + H
2
O + H
3
O
+
+ H
2
O + H
3
O
+
Erklärung für die beobachtete elektrische Leitfähigkeit der konz. Essigsäure und der wässrigen Essigsäurelösung:
Die Säure gibt ein H
+
an das Wasser ab, dadurch entsteht ein positiv geladenes H
3
O
+
-Ion und ein negativ geladenes Carboxylation. Es sind also geladene Teilchen in der Lösung vorhanden.
Die saure Reaktion
|
Speiseessig |
Zitronensaft |
Joghurt |
Leitungswasser |
|
|
pH-Wert |
ca. 2,5 |
ca. 2,5 |
ca. 3,8 -6,5 |
ca. 7 (6-8,5) |
|
enthaltene Säure |
Essigsäure |
Citronensäure/
|
Milchsäure |
- |
Damit eine Lösung sauer reagiert, müssen „saure Teilchen“, die H
3
O
+
-Ionen in der Lösung vorhanden sein.
Reaktionsgleichung: siehe oben
Erklärung:
Wenn eine Säure mit Wasser reagiert, bilden sich H
3
O
+
-Ionen. Diese sind für die saure Reaktion verantwortlich.
physik_und_chem_eigenschaften_von_alkansaeuren_gruppenarbeit.:
Herunterladen
[docx][132 KB]
physik_und_chem_eigenschaften_von_alkansaeuren_gruppenarbeit.:
Herunterladen
[pdf][702 KB]