Atombindung
Arbeitsblatt
Nichtmetalle verbinden sich über bindende Elektronenpaare zu Molekülen. In diesen ordnen sich die Atome so an, dass sie die gleiche Zahl von Elektronen wie die Edelgase in ihrer Umgebung besitzen. Die Summenformel gibt die Zahl der Atome im Molekül an, die Strukturformel die Anordnung der Atome im Molekül. In der Lewis-Schreibweise werden ein Elektron als Punkt und ein Elektronenpaar als Strich dargestellt. Die Bindung zwischen den Atomen entsteht durch bindende Elektronenpaare. Dazu liefert jedes der beiden Atome ein Elektron. Manche Atome besitzen auch nichtbindende Elektronenpaare.
Beispiel:
|
Summenformel |
Strukturformel |
|
HCl |
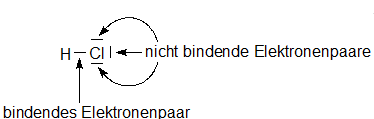
|
Aufgabe
Zeichne die Strukturformeln der folgenden Moleküle mit allen bindenden und nicht bindenden Elektronenpaaren.
|
Summenformel |
Strukturformel |
|
H 2 |
|
|
O 2 |
|
|
H 2 O |
|
|
N 2 |
|
|
CO 2 |
|
|
CH 4 |
|
|
Cl 2 |
|
|
NH 3 |
Aufgabe
Bilde aus den folgenden Elementen Moleküle und zeichne deren Strukturformeln.
|
H und F |
|
|
H und Cl |
|
|
C und H |
|
|
N und H |
|
|
C und F |
|
|
C und Cl |
|
|
C und O |
|
|
S und H |
|
|
P und H |
atombindung_arbeitsblatt: Herunterladen [pdf][18 KB]
atombindung_arbeitsblatt: Herunterladen [doc][38 KB]
