Metalle und Metallbindung

Du bist der Professor/die Professorin:
Ein Professor hat einen wissenschaftlichen Text über die Metallbindung erstellt und möchte von dir als seinem Kollegen wissen, ob der Text verständlich ist.
- Lies den Text zur Metallbindung sorgfältig durch.
- Erstelle für die Metallbindung eine Zeichnung.
- Gehe mit Mitschülern zu dritt oder zu viert zusammen, wobei mindestens einer in der Gruppe kein Professor ist. Tauscht euch aus, erklärt euch gegenseitig die Metallbindung.
Zusatzaufgabe für schnelle Gruppen:
Überlegt euch mithilfe der Metallbindung Erklärungen für die elektrische Leitfähigkeit und die Duktilität von Metallen.
"Schwach elektronegative Atome, die eine starke Neigung haben, ein, zwei oder drei Elektronen abzugeben und zu positiven Ionen zu werden, können sich zu einer speziellen Sorte von Festkörpern zusammenlagern, ohne dass negative Ionen beteiligt wären. Wir haben es mit Metallen zu tun. Ein Metall ist eine kristalline, regelmäßige Anordnung von positiven Ionen, deren jedes Elektronen aus seiner äußersten, unvollständig gefüllten Elektronenschale abgegeben hat (…). Diese Elektronen sind beweglich und können frei von einem Ende des Metalls zum anderen wandern. Die Elektronen umschließen die positiven Ionen und halten das Metall zusammen. Ohne sie würde die ganze Gewalt der elektrostatischen Abstoßung zwischen den positiven Ionen das Metall auseinanderfliegen lassen. Mit den Elektronen können die positiven Ionen zusammengepackt werden wie Murmeln in einer Schachtel. Die Strukturen der meisten Metalle sind tatsächlich so einfach: Sie repräsentieren die Möglichkeiten, möglichst viele Kugeln auf begrenztem Raum unterzubringen. Lithium-Metall wird durch ein Elektron je positives Ion zusammengehalten, Beryllium durch doppelt so viele Elektronen. Die zusätzlichen Elektronen bewirken, dass die positiven Ionen fester zusammengehalten werden und dass dadurch Beryllium ein härteres Metall als Lithium ist. Der Aufenthalt dieser Elektronen ist nicht wie bei einem Gas auf ein Atom begrenzt, sondern die Elektronen sind vollständig delokalisiert." |
Text mit freundlicher Genehmigung des Verlags übernommen aus: Dickerson / Geis: Chemie – eine lebendige und anschauliche Einführung, Weinheim: Verlag Chemie 1981. S.40, S.86ff

Du bist der Assistent/Assistentin vom Professor:
Ein Professor hat verschiedene Bilder zur Veranschaulichung der Metallbindung erstellt und möchte von dir als seinem Assistenten wissen, ob sie verständlich sind.
- Schaue dir die Bilder zur Metallbindung sorgfältig an.
- Erkläre mithilfe der Bilder die Metallbindung in eigenen Worten.
- Gehe mit Mitschülern zu dritt oder zu viert zusammen, wobei mindestens einer in der Gruppe kein Assistent ist. Tauscht euch aus, erklärt euch gegenseitig die Metallbindung.
Zusatzaufgabe für schnelle Gruppen:
Überlegt euch mithilfe der Metallbindung Erklärungen für die elektrische Leitfähigkeit und die Duktilität von Metallen.
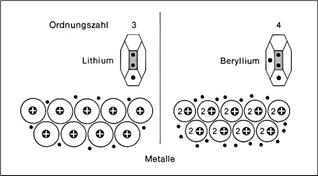
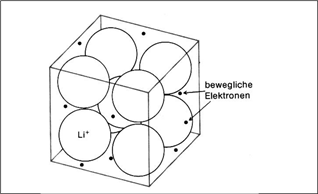
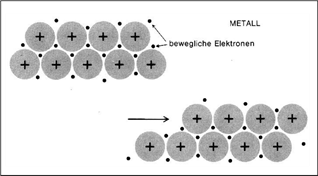
Abbildungen mit freundlicher Genehmigung des Verlags übernommen aus: Dickerson / Geis: Chemie – eine lebendige und anschauliche Einführung, Weinheim: Verlag Chemie 1981. S.40, S.86ff

Du bist Schüler/Schülerin
In dem folgenden Text wird der Aufbau von Metallen und die Metallbindung erklärt.
- Lies den Text sorgfältig durch, schaue dir das Bild dazu an.
- Erkläre die Metallbindung in eigenen Worten.
- Gehe mit Mitschülern zu dritt oder zu viert zusammen, wobei mindestens einer in der Gruppe kein Schüler ist. Tauscht euch aus, erklärt euch gegenseitig die Metallbindung.
Zusatzaufgabe für schnelle Gruppen:
Überlegt euch mithilfe der Metallbindung Erklärungen für die elektrische Leitfähigkeit und die Duktilität von Metallen.
Die Metallische Bindung
Die meisten Elemente sind Metalle. Alle Metalle leiten die Elektrizität sowohl im festen als auch im flüssigen Zustand und sind duktil (verformbar, schmiedbar).
Die Stoffteilchen von Metallen sind Atome im Atomverband. Nun stellen sich die folgenden Fragen:
- Wie kann man sich eigentlich eine Bindung zwischen Metall-Atomen vorstellen?
- Wie erreichen Metall-Atome im Atomverband eine Art "Edelgaskonfiguration"?
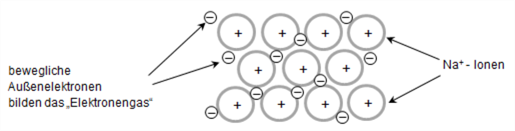
Die Bindung zwischen Metall-Atomen wird mit dem Elektronengasmodell erklärt:
Metall-Atome geben relativ leicht ihre Außenelektronen (Valenzelektronen) ab. Im Elektronengasmodell geht man davon aus, dass jedes Metall-Atom seine Außenelektronen "abgegeben" hat. Die nun positiv geladenen Metall-Ionen sind in einem regelmäßigen Gitter, dem sogenannten Metallgitter, angeordnet. Die "abgegebenen" Außenelektronen aller Metall-Atome bewegen sich innerhalb dieses Gitters frei zwischen allen Metall-Ionen und bilden das sogenannte "Elektronengas".
Die elektrostatischen Anziehungskräfte zwischen den positiv geladenen Metall-Ionen und den negativ geladenen Elektronen sorgen für den Zusammenhalt zwischen den Metall-Atomen, man spricht von der metallischen Bindung.
Bildliche Darstellung der metallischen Bindung am Beispiel Natrium:
Metalle und Metallbindung: Herunterladen [docx][4 MB]
Metalle und Metallbindung: Herunterladen [pdf][844 KB]
Weiter zu Materialien
