Salze: Löslichkeit in Wasser
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
Schülerarbeitsblatt
Bestimmung des Salzgehaltes in einer konzentrierten Kochsalzlösung < 1
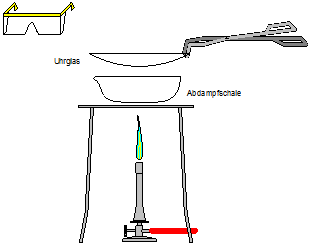
Versuchsaufbau
Bildquelle: (c) Vollmer, Adam: Chemieversuche, Vorlagen für die Sekundarstufe I und II. Hedinger. Stuttgart 2010
Versuchsdurchführung
Zuerst wird die Abdampfschale gewogen und das Gewicht notiert. Danach werden in die Abdampfschale 10 mL der gesättigten Salzlösung abpipettiert und die Schale mit der Lösung gewogen. Der Wert wird notiert. Anschließend wird die Lösung vorsichtig mit einem Bunsenbrenner eingedampft. Gegen Ende des Versuches hält man ein Uhrglas über die Schale, um verspritzendes Salz aufzufangen. Wenn alles Wasser verdampft ist, wird die abgekühlte Schale mit dem Salz gewogen und dieser Wert bestimmt.
Aufgaben
1. Berechne die Dichte der Lösung.
2. Berechne die Löslichkeit des Salzes in Gramm pro 100 g Wasser.
Die Löslichkeit von Salzen in Wasser bei verschiedenen Temperaturen
Bei den meisten Salzen nimmt die Löslichkeit mit steigender Temperatur.
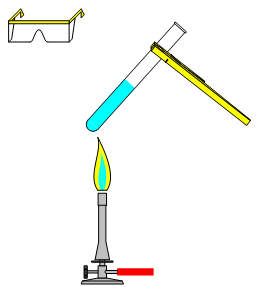
Versuchsdurchführung
Ein Reagenzglas wird zur Hälfte mit Wasser gefüllt und erhitzt. Anschließend gibt man einige Spatelspitzen Kaliumnitrat hinzu und hält das Reagenzglas zum Abkühlen in fließendes Leitungs¬wasser. Fällt kein Salz aus, so muss noch mehr KNO
3
hinzu gegeben werden. Danach wird erhitzt und wieder abgekühlt.
Notiere deine Beobachtungen.
1 Nach: Vollmer, Adam: Chemieversuche, Vorlagen für die Sekundarstufe I und II. Hedinger. Stuttgart 2010
Lehrearbeitsblatt
Bestimmung des Salzgehaltes in einer konzentrierten Kochsalzlösung < 1
Versuchsaufbau
Bildquelle: (c) Vollmer, Adam: Chemieversuche, Vorlagen für die Sekundarstufe I und II. Hedinger. Stuttgart 2010
Versuchsdurchführung
Zuerst wird die Abdampfschale gewogen und das Gewicht notiert. Danach werden in die Abdampfschale 10 mL der gesättigten Salzlösung abpipettiert und die Schale mit der Lösung gewogen. Der Wert wird notiert. Anschließend wird die Lösung vorsichtig mit einem Bunsenbrenner eingedampft. Gegen Ende des Versuches hält man ein Uhrglas über die Schale, um verspritzendes Salz aufzufangen. Wenn alles Wasser verdampft ist, wird die abgekühlte Schale mit dem Salz gewogen und dieser Wert bestimmt.
Aufgaben
1. Berechne die Dichte der Lösung.
2. Berechne die Löslichkeit des Salzes in Gramm pro 100 g Wasser.
Lösung
<
2
Eine gesättigte Kochsalzlösung enthält bei 20 °C 311,3 g NaCl pro Liter und hat eine Dichte von 1,1993 g/mL.
Die Löslichkeit von Salzen in Wasser bei verschiedenen Temperaturen
Bei den meisten Salzen nimmt die Löslichkeit mit steigender Temperatur.
Versuchsdurchführung
Ein Reagenzglas wird zur Hälfte mit Wasser gefüllt und erhitzt. Anschließend gibt man einige Spatelspitzen Kaliumnitrat hinzu und hält das Reagenzglas zum Abkühlen in fließendes Leitungs¬wasser. Fällt kein Salz aus, so muss noch mehr KNO
3
hinzu gegeben werden. Danach wird erhitzt und wieder abgekühlt.

Bildquelle: (c) Vollmer, Adam: Chemieversuche, Vorlagen für die Sekundarstufe I und II. Hedinger. Stuttgart 2010
Notiere deine Beobachtungen.
Die Löslichkeit von KNO 3 nimmt mit steigender Temperatur zu. Beim Abkühlen kristallisiert das Salz aus.
Löslichkeit von KNO 3 bei verschiedenen Temperaturen < 3
|
|
20 °C |
60 °C |
80 °C |
|
KNO 3 in 100 g Wasser |
31,7 g |
109,9 g |
169,0 g |
1 Nach: Vollmer, Adam: Chemieversuche, Vorlagen für die Sekundarstufe I und II. Hedinger. Stuttgart 2010
2 Weast, Robert. C. (Editor in Chief): Handbook of Chemistry and Physics, 53rd Edition. Cleveland, Ohio. D-211
3 Brau, Dieter et al: T Ü F, Tabellen, Übersichten, Formeln. Braunschweig 2008
salze_loeslichkeit_in_wasser_schuelerarbeitsblatt
herunterladen
[doc][90 KB]
salze_loeslichkeit_in_wasser_schuelerarbeitsblatt
herunterladen
[pdf][106 KB]
salze_loeslichkeit_in_wasser_lehrerarbeitsblatt
herunterladen
[doc][94 KB]
salze_loeslichkeit_in_wasser_lehrerarbeitsblatt
herunterladen
[pdf][122 KB]