Schülerversuche mit Präsentation
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
 Lösungshinweise zu den Versuchen
Lösungshinweise zu den Versuchen
Versuch 1: Pflanzenstängel in demineralisiertem Wasser

Abbildung 1:
Rhabarber nach Plasmolyse
Quelle: ZPG Biologie
-
Formulieren Sie eine Fragestellung / Hypothese und beschreiben Sie Ihre Beobachtungen.
Fragestellung: Wie verändert sich ein Rhabarberstängel in demineralisiertem Wasser?
Hypothese z.B: Er wird dünner. Er wird dicker. Er schrumpft in sich zusammen. Er rollt sich auf.
Beobachtung: Bei dem gespaltenen Stängel im Wasser haben sich die einzelnen Gewebestreifen nach außen aufgerollt. -
Erklärung:
Steht der Stängel in konzentrierter Kochsalz- oder Zuckerlösung, so geben die Zellen osmotisch Wasser ab. Die Gewebestreifen sind nicht oder nur noch wenig gekrümmt.
Die Zellwände lebender, unverholzter Zellen, wie sie im saft igen Pflanzenstängeln vorkommen, sind meist elastisch. Außer von der Zellwand sind die Zellen von einer semipermeablen Membran umgeben. Der Zellsaft hat eine höhere Konzentration an gelösten Teilchen als reines Wasser der Umgebung. Deshalb strömt osmotisch Wasser in die Zellen ein, bis sie prall gefüllt sind. Es entsteht ein Druck von innen auf die Zellwand (Turgordruck). Da die einzelnen Zellen im Stängel in einen Gewebeverband eingebunden sind, können sie sich durch die Wasseraufnahme nur bedingt ausdehnen. Der ungespaltene Stängel behält deshalb seine ursprüngliche Form bei und krümmt sich nicht.
Durch das Einschneiden der Stängel werden Bindungen im Zellgewebe zerstört. Zuvor eingeengte Zellen können sich nun ausdehnen. Sie nehmen so lange Wasser auf, bis der Druck innerhalb und außerhalb der Zelle ausgeglichen ist. Die Krümmung der Stängelstreifen wird gefördert, da Zellen unterschiedlicher Stängelschichten verschieden elastisch sind und sich bei Wasseraufnahme unterschiedlich stark ausdehnen können. So sind die Zellwände im Stängelinneren elastischer als an der Stängelaußenseite. Wenn der Stängel in reinem Wasser steht, nehmen die inneren Zellen mehr Wasser auf als die äußeren, ihr Zellinnendruck ist dann höher und die Stängelstreifen rollen sich nach außen.
Manchmal kann man am Wegesrand Stiele von Löwenzahnblütenköpfchen entdecken, die zufälligerweise kurz unterhalb der Blüte abgeschnitten oder abgebissen worden sind. Beim Eintrocknen des bei der Verletzung gespaltenen Stieles können sich beide Enden schneckenförmig aufrollen.
-
Rückgängig machen durch Ersetzen der Zucker bzw. Salzlösung durch demineralisiertes Wasser. Die eingerollten Stängel strecken sich wieder.
Nach: Steinecke H., Meyer I., Pohl-Apel G. (2007). Kleine botanische Experimente mit CD-ROM. Frankfurt : Verlag Harri Deutsch
-
Formulieren Sie eine Fragestellung und Hypothese(n).
Wie verändern sich gleich große Gewebestücke von Kartoffeln in Zuckerlösungen bei verschiedenen Konzentrationen? Hypothesen z.B. Die Länge nimmt mit zunehmender Zuckerkonzentration zu.
-
Mögliches Messergebnis:
Konzentration
0%
5%
10%
15%
20%
25%
30%
Länge in cm
4,3
4,2
4,1
4,0
3,8
3,6
3,5
-
Erklärung:
In der Lösung mit w = 15% blieb die Länge des Zylinders unverändert. Diese Konzentration ist isotonisch zum Zellsaft der Kartoffelzellen. In niedriger konzentrierten Lösungen kommt es zum osmotischen Wassereinstrom, bei höher konzentrierten Lösungen zum osmotischen Wasserausstrom aus den Kartoffelzellen.
-
Stärke → große Moleküle, nicht löslich, osmotisch nicht wirksam, Kompaktspeicherung: mehr Energie auf weniger Raum;
Glucose → relativ kleine Moleküle, löslich, osmotisch wirksam, weniger Energie pro Volumeneinheit
Versuch 3: Pflanzengewebe mit verschiedenen Feststoffen


Abbildung 2ab:
Pflanzengewebe mit verschiedenen
Feststoffen,
a:
zu Beginn,
b.
nach 15 Minuten
Quelle: ZPG Biologie
-
Formulieren Sie eine Fragestellung und eine Hypothese.
Wie verändern die Feststoffe Salz, Zucker und Stärke das Gewebe von Kartoffeln?
Die Kartoffel schrumpft. Die Kartoffel saugt die Stoffe auf.
-
Beobachtung:
Die Kartoffelhälften mit Salz und Zucker füllen sich mit Flüssigkeit, die Kartoffelhälfte mit Stärke sowie die ungefüllte Kartoffelhälfte bleiben unverändert.
-
Erklärung:
Salz und Zucker sind osmotisch wirksam, den Kartoffelzellen wird Wasser entzogen. Stärke ist nicht osmotisch wirksam.
-
Stärke → große Moleküle, nicht löslich, osmotisch nicht wirksam, Kompaktspeicherung: mehr Energie auf weniger Raum;
Glucose → relativ kleine Moleküle, löslich, osmotisch wirksam, weniger Energie pro Volumeneinheit
Versuch 4: Gasaustausch

Abbildung 3:
Diffusion von Kohlenstoffdioxid
durch eine semipermeable Membran
(links), Vergleichslösung (rechts)
Quelle: ZPG Biologie
-
Formulieren Sie eine Fragestellung und eine Hypothese.
z.B. Kann Kohlenstoffdioxid durch eine semipermeable Membran diffundieren? Kohlenstoffdioxid kann durch eine Membran diffundieren, weil die Teilchen klein sind.
-
Modellexperiment: Kohlenstoffdioxid wird z.B. aus den Zellen ins Blut abgegeben. Kohlenstoffdioxid passiert dabei die Zellmembran.
-
Beobachtung: Innerhalb von wenigen Minuten entfärbt sich die pinkfarbene Lösung, in dem Glas, das den Mineralwasser-Schlauch enthält. Die Lösung im anderen Glas ändert ihre Farbe nicht.
-
Erklärung: Kohlenstoffdioxid diffundiert aus dem Schlauch in die umgebende Lösung. Kohlenstoffdioxid reagiert mit Wasser zu einer sauren Lösung durch Bildung von Oxonium-Ionen. Die saure Lösung neutralisiert die Natronlauge. Phenolphthalein zeigt durch die Entfärbung an, dass die alkalische Lösung verschwindet.
Versuch 5: Eier ohne Schale



Abbildung 4 a, b,c:
Osmose bei Hühnereiern
Bildquelle: ZPG Biologie
Herstellung der Lösungen :
- Essigsäure (w = 10%): 100g Essigessenz (w = 25 %) mit 150g Wasser auffüllen.
- Gesättigte Salzlösung: 50 g Salz in 150 mL Wasser langsam unter ständigem Rühren lösen.
-
Natriumchloridlösung (w = 5 %): 10 g Kochsalz in 190 mL Wasser lösen.
-
Fragestellung: Können Hühnereier ohne Schale durch die Eihaut Stoffe aufnehmen?
Hypothese: Die Haut der Hühnereier ist wasserdurchlässig. Die Haut der Hühnereier ist für Zucker oder Kochsalz durchlässig. -
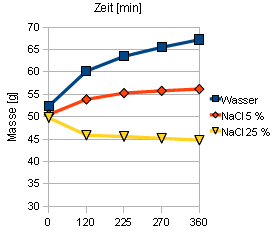
Beobachtung: Die „geschälte“ Eihälfte vergrößert sich in demineralisiertem Wasser, platzt eventuell. In der Zuckerlösung schrumpft der Inhalt des Eis. Bei der 5%igen Kochsalzlösung bleibt das Ei unverändert. Messreihe als Wertetabelle Zeit/ Masse
-
Erklärung:
Die Eihaut ist eine semipermeable Membran im Gegensatz zur Kalkschale, die wasserundurchlässig ist.
Demineralisiertes Wasser: hypotonische Lösung außen, Wasser dringt osmotisch in das Ei ein.
Kochsalzlösung, 5%ig: ungefähr isotonische Lösung, bleibt gleich.
Kochsalzlösung gesättigt: hypertonische Lösung außen, Wasser strömt aus dem Ei heraus.
Entkalkung des Eis:
CaCO 3 + 2 H 3 O + → Ca 2+ + CO 2 + 3 H 2 O
Gasentwicklung durch CO 2
nach: Holl, G., Jaenicke, J., Monzer, A. (1995). Biologie heute Ökologie. Hannover: Schroedel
Beispielwerte aus einem Schülerexperiment
|
|
Lösungshinweise:
Herunterladen
[pdf]
[265 KB]
Lösungshinweise: Herunterladen [doc] [10,7 MB]