Batterien und Akkumulatoren
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
Für diese Doppelstunde im zweistündigen Fach müssen in Anbetracht der Vielfalt aktueller Batterien und Akkumulatoren einige exemplarisch ausgewählt werden.
Die Autoren entschieden sich für die klassische Variante:
- die Taschenlampenbatterie (Leclanché-Element) und den
- Bleiakkumulator.
Dafür sprechen mehrere Gründe:
- Beide besitzen, obwohl im Prinzip schon über 150 Jahre alt, noch heute einen hohen Aktualitätsbezug und weite Verbreitung.
- An den beiden Systemen sind die Grundprinzipien einer Batterie und eines wiederaufladbaren Akkumulators experimentell leicht erschließbar . Dies kann beim Leclanché -Element im Schülerversuch erfolgen; beim Bleiakkumulator ist ein Lehrerdemonstrationsversuch möglich.
- Die Elektrodenreaktionen sind schwieriger als bei den bisher besprochenen galvanischen Elementen, jedoch im Gegensatz zu anderen Batterien/Akkumulatoren überschaubar und für Schülerinnen und Schüler des zweistündigen Kurses erschließbar.
- Bei der Besprechung des Ladevorgangs des Bleiakkumulators kann die Elektrolyse als erzwungene Redoxreaktion und Umkehrung des freiwillig ablaufenden Entladevorgangs besprochen werden. Eine vertiefte Behandlung der Elektrolyse ist schon hier mit den Nebenreaktionen beim Laden („Gasen“ des Bleiakkus) möglich. Ggf. kann schon auf Vorwissen aus der Mittelstufe zurückgegriffen werden.
- Hier bietet auch das eingeführte Lehrbuch so viel Material, dass Inhalte zum Teil selbstständig mit dem Lehrbuch erschließbar sind.
- Bei diesen Elektrodenreaktionen bietet sich eine gute Gelegenheit, die Redoxreaktionen mit Hilfe von Oxidationszahlen zu beschreiben. Im Gegensatz zu den vorher besprochenen einfachen Redoxreaktionen ist hier dieses Konzept wirklich sinnvoll.

|
Abb.1: Praktikumsversuch:
Schülerarbeitsplatz zum Bau einer Taschenlampenbatterie (Versuchsanleitung nach Lehrbuch) |

|
Abb.2:
Lehrerdemonstrationsversuch: Ladevorgang bei einem Bleiakkumulator; sichtbares Gasen bei erhöhter äußerer Spannung |

|
Abb.3:
Zellspannung eines geladenen Bleiakkumulators |

|
Abb.4:
Der Bleiakkumulator betreibt einen Propellermotor; nach etwa 10 s muss erneut geladen werden. |
Bei Interesse und zur Förderung besonders interessierter Schülerinnen
und Schüler können weitere Batterien und Akkumulatoren bearbeitet
werden. Hier ist beispielsweise eine GFS möglich. Texte zu Nickel-Cadmium-Akkumulatoren,
Nickel-Metallhydrid-Akkumulatoren und Lithium-Ionen-Akkumulatoren sind in den
aktuellen Lehrbüchern enthalten.
Zur experimentellen Veranschaulichung von Lithium-Batterien eignet sich ein einfacher Modellversuch, der allerdings nicht einfach zu interpretieren ist:
V: Bau einer Lithium-Zelle (Modellversuch)
Geräte und Chemikalien :
Petrischale, Rundfilter, Pinzette, Stativmaterial, Multimeter, Experimentierkabel,
Krokodilklemmen, Mikromotor, Messer, Papiertücher.
Kupferblech (rechtwinklig gebogen), Graphitelektrode (evtl. mit Buchse),
CuSO4-Lösung (c = 1 mol·L
-1)
in Spritzflasche, Lithium,
Gefäß mit Spiritus-Wasser-Gemisch (1:1) für Li-Abfälle.
Durchführung: < 1 <
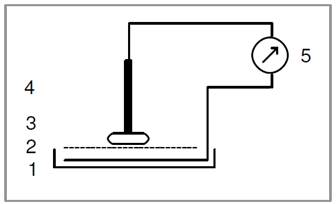
- Legen Sie das rechtwinklig gebogene Kupferblech (1) auf den Boden der Petrischale und verbinden es über eine Krokodilklemme mit einem Kabel.
- Decken Sie das Kupferblech mit einem passend geschnittenen Filterpapier (2) ab.
- Pipettieren Sie einige Tropfen Kupfersulfat-Lösung auf das Filterpapier.
- Legen Sie mit der Pinzette ein frisch entrindetes, gut abgetrocknetes Stück Lithium (3) auf die mit Kupfersulfat-Lösung befeuchtete Stelle des Filterpapiers.
- Drücken Sie die Graphitelektrode (4) von oben fest auf das Li-Stück und befestigen Sie diese mit einer Klammer am Stativ.
- Verbinden Sie den Graphitstab ebenfalls mit einem Kabel.
- Schließen Sie das Multimeter (5) an, stellen Sie den geeigneten Messbereich ein und lesen Sie die Spannung ab.
- Ersetzen Sie das Multimeter durch den Mikromotor.
Auswertung:
- Ermitteln Sie die Redoxpaare. Formulieren Sie die Reaktionsgleichungen, die in obiger Lithium-Zelle bei Stromentnahme an den Elektroden ablaufen.
-
Für industriell gefertigte Lithium-Zellen werden keine wasserhaltigen Elektrolyt-Lösungen eingesetzt, sondern spezielle organische, polare Lösungsmittel wie z. B. Ketone oder Ester.
Begründen Sie den Sachverhalt.
Entsorgung:
Spülen Sie das Kupferblech gut mit Wasser.
Geben Sie das Lithiumstück in das Gefäß mit dem Spiritus-Wasser-Gemisch.
1 Entnommen aus: Schülerlabor Xplore, BASF 2006, verändert.
Batterien und Akkumulatoren: Herunterladen [doc] [204 KB]
Batterien und Akkumulatoren: Herunterladen [pdf] [244 KB]