Weitergehende Information
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Die MacGyver-Batterie
oder
Die Aluminium-Luft (Sauerstoff)-Batterie
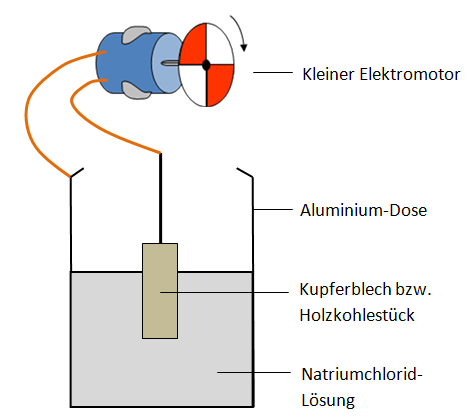
Elektrodenreaktionen:
|
Minuspol: Al ( ) → Al
3
+ ( ) + 3e
-
Oxidation/Anode Aluminium |
|
Pluspol: O
2
( ) + 4 e
-
+ 2 H
2
O ( ) → 4 OH
-
( )
Reduktion/Kathode/ Kupfer, Graphit oder Holzkohle |
Als Elektrolyt dient Natriumchlorid-Lösung
Weitergehende Information:Würde die Natriumchlorid-Lösung durch eine Natriumsulfat- oder Natriumnitrat-Lösung ersetzt, würde die Batterie nicht mehr funktionieren. Die Chlorid-Ionen besitzen nämlich die Fähigkeit, mit den Aluminium-Ionen der Aluminiumoxidschicht zu reagieren und so die Deckschicht löchrig zu machen. In diesen Bereichen steht dann das Metall Aluminium im direkten Kontakt mit der Elektrolyt-Lösung und die Aluminium-Atome können an dieser Anode in Lösung gehen. Vereinfacht lässt sich der Vorgang des Ablösens der in Wasser unlöslichen Aluminiumoxidschicht mit der folgenden Reaktionsgleichung beschreiben: Al 2 O 3 (s) + 8 Cl - (aq) + 3 H 2 O (l) → 2 [AlCl 4 ] - (aq) + 6 OH - (aq)
Der entstandene Tetrachloroaluminat-Komplex wird anschließend hydrolysiert:
|
MacGyver-Batterie: Herunterladen [doc] [1,1 MB]
MacGyver-Batterie: Herunterladen [pdf] [577 KB]
