Lösungsansatz und Hinweise
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
Lösungsansatz und Hinweise zur Auswertung des Experiments
Abgestufte Lernhilfe: Dieses Kärtchen kann am Lehrertisch
ausgelegt werden.
|
Lösungshilfe Aufgabe 1:
|
Zu Aufgabe 1:
Die Aussage ist richtig, da laut Abbildung Chlor-Moleküle stärkere Oxidationsmittel als Brom-Moleküle und Iod-Moleküle sind und somit den Bromid- und Iodid-Ionen Elektronen „entreißen“ können!
Aufgabe2:
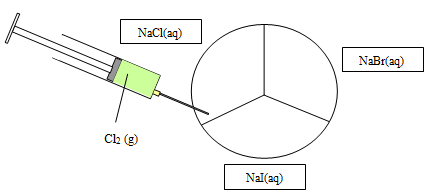
|
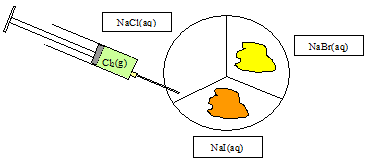
|
Redoxgleichungen:
Ox: 2 I
–
→ I2 + 2 e-
|
Zu Aufgabe 5:
Je kleiner der Atomradius des Halogen-Atoms ist, desto größer ist die Elektronenaffinität.
Je größer die Elektronenaffinität ist, desto stärker ist die Fähigkeit des Halogenatoms ein Elektron aufzunehmen und als Oxidationsmittel zu wirken.
Neben der Elektronenaffintät spielen auch Bindungsenergien zwischen den Halogenmolekülen und Hydratationsenergien eine Rolle. (Hinweis: Fluor zeigt deshalb ein abweichendes Reaktionsverhalten!)
Zu Aufgabe 6:
Kontrollexperimente mit Brom- (aus Dampfphase der Bromflasche abziehen) statt
Chlor-gefüllter Spritze oder Iod-Lösung sind denkbar, zeigen aber
keine so eindeutige Farbreaktion (Bromdämpfe diffundieren aus der Lösung
so dass es auch in der Chlorid-Lösung zu einer scheinbaren Entfärbung
kommt). Die Gelbfärbung durch gebildetes Iod lässt sich nur durch
Versetzen mit Stärkelösung von der Gelbfärbung durch Brom unterscheiden.
Bei Zugabe von Iodlösung bleibt in allen Fällen die Gelbfärbung
bestehen woraus geschlossen werden muss, dass nichts passiert.
Für die Versuchsskizzen wurde das Tool "Zeichnen von Versuchsskizzen"verwendet.
http://www.schule-bw.de/unterricht/faecher/chemie/material/nuetzliches/skizze/
(06.11.2012)
Quelle:
Birger Pistohl: „Experimentelle Aufgabenstellungen
im Chemieunterricht“,
Akademiebericht Nr. 434 der Akademie für Lehrerfortbildung und Personalführung
Dillingen, S. 176-178.
Mit freundlicher Genehmigung der Akademie für Lehrerfortbildung und Personalführung
Dillingen
Redoxreihe der Halogene - Praktikum: Herunterladen [doc] [74 KB]
Redoxreihe der Halogene - Praktikum: Herunterladen [pdf] [148 KB]
