Brennstoffzelle
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
Bezug
: Lehrplaneinheit 8: Elektrochemie / Prinzip einer Brennstoffzelle
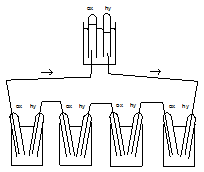
Information :
Die erste Brennstoffzelle wurde 1839 von
Sir William Robert Grove
(1811-1896) entwickelt. Vorausgegangen war die Entdeckung, dass die Elektrolyse
umkehrbar ist.
Die Abbildung zeigt eine Brennstoffzelle von 1842, die
Grove
aus vier hintereinander geschalteten Zellen konstruierte. In den vier
unteren Gefäßen befindet sich verdünnte Schwefelsäure,
in die je zwei Glasröhren mit Platin-Elektroden eintauchen. Im oberen Teil
der Glasröhren befinden sich entweder Sauerstoff (Oxygen) oder Wasserstoff
(Hydrogen).
Der dabei erzeugte Strom versorgt hier einen Elektrolyseur (oberes Gefäß).
Geräte und Chemikalien :
Becherglas (150 mL, h.F.), Separator (Trennwand), 2 Graphitelektroden, 2 Kabel, 2 Krokodilklemmen, Trafo, Multimeter, Mikromotor, Stativmaterial, Kalilauge (c(KOH) ≈ 1 mol·L -1 ).
Für V2: Graphitelektroden mit geeigneten Katalysatoren: C/Pd als Wasserstoffelektrode und C/Ag als Sauerstoffelektrode (Herstellung, siehe unten).
Aufgaben :
- Bestimmen Sie die Spannung der Brennstoffzelle.
- Wie lange läuft der Mikromotor?
- Formulieren Sie die Reaktionsgleichungen der an den Elektroden ablaufenden Reaktionen.
- Vergleichen Sie die Wirksamkeit der Elektroden ohne und mit katalytisch wirksamen Metallen.
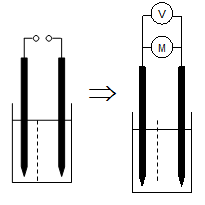 Versuch
1
:
Versuch
1
:
Die Graphitelektroden werden in die Kalilauge getaucht und an den Gleichspannungstrafo angeschlossen. Ein Separator verhindert, dass sich die Elektroden berühren. Für die kurzzeitige (1-2 min) Elektrolyse wird die Spannung so weit erhöht, dass an den Elektroden eine geringe Gasentwicklung erfolgt. Hierbei beladen sich die Graphitstäbe in ihrem feinporigen Gefüge mit den entsprechenden Gasen. Nach der Elektrolyse wird die Spannungsquelle durch ein Voltmeter und einen Mikromotor ersetzt.
Versuch 2 :
Wie Versuch 1, aber statt der normalen Graphitelektroden werden folgende, mit katalytisch wirksamen Metallen ausgestattete Graphitelektroden eingesetzt:
- Sauerstoffelektrode (blau markiert):Graphit / Silber
- Wasserstoffelektrode (rot markiert): Graphit / Palladium
Bitte Polung beachten!
Auswertung:
Herstellung der katalytisch wirksamen Graphitelektroden : < 1
- Sauerstoffelektrode: Die Graphitelektrode wird als Kathode in eine Silbernitratlösung (w≈2 %) gestellt. Als Anode dient eine weitere Graphitelektrode. Bei U ≈ 3 V wird ca. 10 Minuten lang elektrolysiert. Die Elektrode wird getrocknet und mit blauer Markierung z.B. in einem Reagenzglas aufbewahrt.
- Wasserstoffelektrode: Die Graphitelektrode wird als Kathode in eine Palladiumchloridlösung (w ≈ 0,2 %) gestellt. Als Anode dient wieder eine Graphitelektrode. Bei U ≈ 3 V wird 0,5 bis 1 Stunde lang elektrolysiert. Die Elektrode wird getrocknet und mit roter Markierung z.B. in einem Reagenzglas aufbewahrt.
Versuch 3 : Membran-Brennstoffzelle
( PEMFC = proton exchange membrane fuel cell)

Die Schläuche enden in Bechergläsern mit dest. Wasser. Nach Anschluss eines Voltmeters oder eines Mikromotors werden die Gasventile
vorsichtig (!)
so weit geöffnet, dass ein wenig überschüssiges Gas über die Schläuche ins Wasser entweicht. Es genügt, wenn etwa alle 10 Sekunden eine Glasblase austritt.
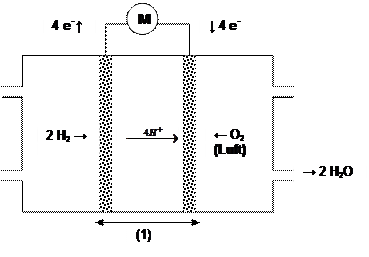 Prinzip
: Siehe Skizze (rechts)
Prinzip
: Siehe Skizze (rechts)
(1) ist eine Protonenaustauschmembran (PEM).
Sie übernimmt folgende Aufgaben:
- Elektrolyt
- Katalytisch wirksame Gasdiffusions-elektroden (Gewebe aus platinierten Kohlefasern)
Versuch 4 : Brennstoffzellen-Stack

|
Um höhere Leistungen zu erzielen, werden viele Einzelzellen zu einem Brennstoffzellen-Stack (-Stapel) in Reihe geschaltet (Bild). Betriebsbereitschaft herstellen :
|
Durchführung :
- Schließen Sie einen Mikromotor an.
- Geben Sie aus dem Kolbenprober ca. 10 mL Wasserstoff zu. Wenn die Motorleistung nachlässt, fügen Sie die nächste kleine H 2 -Portion zu, usw.
Versuch 5 : Direkt-Methanol-Brennstoffzelle (DMFC)
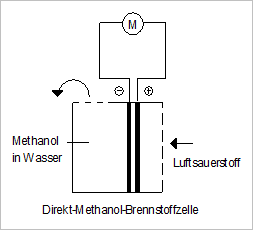
Analoger Aufbau wie Membran-Brennstoffzelle.
Unterschied: Als Brennstoff dient Methanol anstelle von Wasserstoff.
| Anode: |
CH
3
OH + H
2
O → CO
2
+ 6 e
-
+ 6 H
+
| ·2
|
| Kathode: | O 2 + 4 e - + 4 H + → 2 H 2 O | ·3 |
|
|
|
| 2 CH 3 OH + 3 O2 → 2 CO 2 + 4 H 2 O | |
1 W. Jansen, M. Kenn, B. Flintjer, R. Peper: Elektrochemie, Aulis Verlag, ISBN 3-7614-0603-7, 3. Aufl., 1985, S. 58/59, verändert
Brennstoffzelle: Herunterladen [doc] [93 KB]
Brennstoffzelle: Herunterladen [pdf] [209 KB]
