Protonenübertragungsreaktionen
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
Inhalte:
- Experimentelle Bestätigung, dass Oxoniumionen für die sauren Eigenschaften einer Lösung verantwortlich sind.
- Reaktionen von sauren Lösungen auf der Teilchenebene: für die Reaktionen von sauren Lösungen mit Metallen und Metalloxiden (2. Doppelstunde) werden Reaktionsgleichungen erstellt.
Konzeption der Stunde:
Reaktionen von Eisessig sowie konz. Ameisensäure mit Wasser. Änderungen der Leitfähigkeit, Temperatur und des pH-Werts werden gemessen.
* Schüler oder Lehrerversuch
Beobachtungen:
Temperaturerhöhung, Zunahme der Leitfähigkeit, pH-Wert sinkt.
Vergleich mit den Beobachtungen beim Einleiten von Chlorwasserstoff in Wasser.
Interpretation:
Die Schüler leisten die Interpretation und formulieren Reaktionsgleichungen. Sie erkennen
selbst, dass Oxoniumionen für die sauren Eigenschaften verantwortlich sind, da sie in allen drei
sauren Lösungen anwesend sind.
Ergebnis:
Säuren bilden bei der Reaktion mit Wasser positive Oxoniumionen und negative
Säurerestionen. Diese beiden Ionen sind für die elektrische Leitfähigkeit verantwortlich, die
Erwärmung ist eine Folge der Aquatisierung dieser Ionen.
Alle sauren Lösungen enthalten Oxoniumionen.
Ergebnissicherung:
Arbeitsblatt mit Aufgaben zur Einübung von Reaktionsgleichungen.
Reaktionen von sauren Lösungen mit Metallen und Nichtmetallen. Hierzu werden die Versuche der 2. Doppelstunde aufgegriffen und Reaktionsgleichungen formuliert:
Salzsäure und Magnesium:
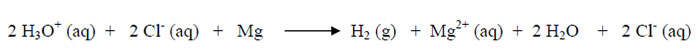
Zink und Salpetersäure: ...
Magnesiumoxid und Salzsäure:

Magnesiumoxid und Essigsäure: ...
*Es werden diese beiden Säuren verwendet, da Schwefelsäure und Salpetersäure Autoprotolyse zeigen und
somit auch in konzentrierter Form den elektrischen Strom leiten. Ameisensäure ist meist so hygroskopisch,
dass immer ein pH-Wert von 1 angezeigt wird. Der Leitfähigkeitsunterschied ist deutlich.
Vorüberlegungen: Herunterladen [doc] [28 KB]
Vorüberlegungen: Herunterladen [pdf] [8 KB]
