Schülerexperimente zum Thema Wasser – ein Oxid
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
Nachfolgend finden sich zwei Schülerexperimente zum Thema ‚Wasser – ein Oxid‘
Beim ersten handelt es sich um ein nachbearbeitendes Experiment, beim zweiten ist das Ziel die Entwicklung bzw. Aufbau einer Versuchsapparatur. Eine bessere (historische) Abbildung findet sich unter der Internetseite
http://www.chemieunterricht.de/dc2/wasser/images/app_lav.gif
SV: Wasser – ein Oxid
Wasserdampf reagiert mit heißem Magnesium: Versuch im Abzug
Materialien: Reagenzglas (Duran), Schutzbrille, Reagenzglasständer, Stativmaterial, Sand, Wasser, Magnesiumband (ca. 5 cm, geschmirgelt), Luftballon, Gasbrenner, Kerze und Schnur.
Durchführung: Das Reagenzglas wird ca. 1 cm hoch mit Sand gefüllt, der anschließend mit Wasser befeuchtet wird. Anschließend legt man das geschmirgelte Magnesiumband gerollt in die Mitte des Reagenzglases und verschließt es mit Hilfe des Luftballons. Das Reagenzglas wird schräg in das Stativ gespannt und an der Stelle, an der sich das Magnesiumband befindet mit der rauschenden Flamme erhitzt. Vorsicht: den Brenner nicht in die Nähe des Luftballons bringen! Sobald das Magnesium zu glühen anfängt wird der Sand mit dem darin enthaltenen Wasser erhitzt, so dass Wasserdampf über das heiße Magnesium geleitet wird. Nach dem Abkühlen (Gasbrenner ausschalten!) wird der Luftballon vorsichtig abgenommen und zugeknotet und an eine Schnur gebunden. Das andere Schnurende wird an einem Stativ befestigt. Anschließend zündet man den Luftballon mit Hilfe einer Kerze, die sich an einem längeren Stab fixiert ist.
Auswertung:
- Fertige eine beschriftete Versuchsskizze an.
- Notiere deine Beobachtungen.
- Nenne Eigenschaften des Reaktionsproduktes, die sich aus den Beobachtungen ableiten lassen.
Bei der Reaktion bildet sich neben Magnesiumoxid das Element Wasserstoff.
- Gib das Reaktionsschema für die ablaufende Reaktion an.
- Gib die Reaktionsgleichung für die ablaufende Reaktion an (Wasserstoff ist aus Molekülen mit der Masse 2u aufgebaut).
SV: Wasser – ein Oxid
1784 wurde von dem französischen Chemiker Antoine Laurant de Lavoisier die Reaktion von Eisen mit Wasser genauer untersucht. Ihm war bekannt, dass sich beim Abschrecken (rasches Abkühlen) von glühenden Eisen mit Wasser auf dem Eisen ein Oxid bildet. Dies ließ ihn vermuten, dass es sich bei Wasser nicht um ein Element sondern um eine Verbindung (genauer um ein Oxid) handelt. Mit einem geeigneten Experiment wollte er mehr über die Natur von Wasser erfahren.
Zur genaueren Untersuchung erhitzte er einen Flintenlauf aus Eisen, in dem sich noch kleine Eisennagelstücke befanden in einem Ofen . Nachdem das Eisenrohr glühte, leitete Lavoisier Wasserdampf durch das Rohr. Das austretende Gas fing er mit Hilfe einer pneumatischen Wanne auf.
Lavoisier nannte das sich bildende brennbare Gas Hydrogenium (Wasserbildner).
Folgende Abbildung zeigt die Apparatur von A. Lavoisier:
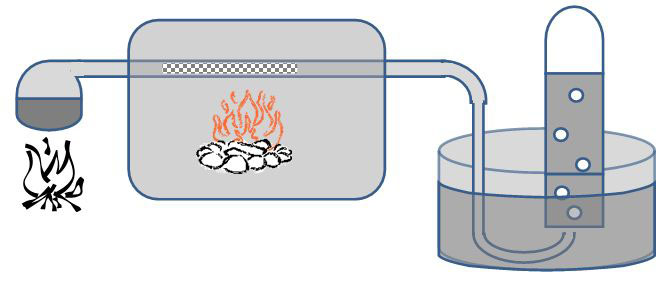
Nach dem Abkühlen konnte Lavoisier Eisenoxid im Eisenrohr nachweisen, das sich bildende Gas war brennbar.
Heute wird der Versuch in der Schule einfacher mit heißem Magnesium durchgeführt, da dieses deutlich besser reagiert.
Aufgabe: In Partnerarbeit
Lest euch den Text aufmerksam durch. Klärt bzw. notiert euch unklare Begriffe.
- Beschriftet die Abbildung mit den im Text fett kursiv gedruckten Worten.
- Erkläre das Funktionsprinzip einer pneumatischen Wanne. Baue mit den ausstehenden Materialien mit deinem Partner eine pneumatische Wanne auf, mit dem du deine Atemluft auffangen kannst.
- Gib die Reaktionsgleichung der ablaufenden Reaktion an.
- Entwerfe mit deinem Partner einen Versuchsaufbau, mit dem die Reaktion von Wasserdampf mit Magnesium durchgeführt werden kann.
Schülerexperimente zum Thema Wasser – ein Oxid:
Herunterladen
[doc]
[129 KB]
Schülerexperimente zum Thema Wasser – ein Oxid:
Herunterladen
[pdf]
[489 KB]
Arbeitsblatt Wasser – ein Oxid:
Herunterladen
[doc]
[127 KB]
Arbeitsblatt Wasser – ein Oxid:
Herunterladen
[pdf]
[485 KB]
