Lösungen
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
- Die Chemie ist die Lehre vom Aufbau, Verhalten und Umwandlung von Stoffen.
- Lösung am Laptop
|
Aggregatzustand bei RT |
Brennbarkeit |
Dichte |
Elektrische Leitfähigkeit |
|
Farbe |
Geruch |
(Geschmack) |
Härte |
|
Kristallform |
Löslichkeit in Ethanol |
Löslichkeit in Benzin |
Löslichkeit in Wasser |
|
Magnetismus |
Oberflächenglanz |
pH-Wert der Lösung |
Schmelztemperatur |
|
Siedetemperatur |
Thermische Leitfähigkeit |
Verformbarkeit |
Zündtemperatur |
-
Entscheide
dich! Was ist schwerer:
- Kann man nicht beantworten
- Ist beides gleich schwer.
- 1dm³ Eisen ist schwerer als 1dm³ Holz, da Eisen eine höhere Dichte hat als Holz
Die Frage (1) ist nicht zu beantworten, daher ist diese Frage nicht sinnvoll gestellt.
-
a)
b)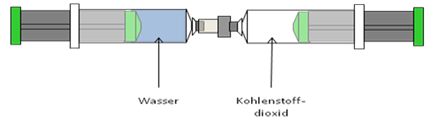
Fülle 30 ml Wasser und 30 ml Kohlenstoffdioxid jeweils in eine 60 ml Spritze. Verbinde die beiden Spritzen und drücke das Wasser zum Kohlenstoffdioxid. Schüttel die Spritzen und schaue wie sich das Gasvolumen verändert. Übe nun Druck auf die Apparatur aus und schüttle erneut. Lasse den Druck nach und schaue gleich wie sich das Gasvolumen verändert hat.
- Führe die folgenden Nachweise durch:
- Nachweis von Wasserstoff (Knallgasprobe): Ein brennendes Streichholz wird an die Reagenzglasöffnung gebracht. Es gibt keinen Plop.
- Nachweis von Sauerstoff (Glimmspanprobe): Ein glimmender Holzspan entzündet sich nicht.
- Nachweis von Kohlenstoffdioxid (Kalkwasserprobe): Beim Schütteln mit Calciumhydroxidlösung tritt keine Trübung auf.
Somit sind die Gase Wasserstoff, Sauerstoff und Kohlenstoffdioxid ausgeschlossen. In dem Gasbeutel könnte sich Stickstoff befinden.
- Die pH-Werte von Null bis Sechs werden einer sauren Lösung zugeordnet. Damit wird zugleich die Stärke der sauren Wirkung angezeigt.
-
Resublimation: Übergang vom gasförmigen zum festen Aggregatzustand.
Kondensation: Übergang vom gasförmigen zum flüssigen Aggregatzustand.. - Diffusion ist die selbstständige Durchmischung von Stoffen aufgrund der Eigenbewegung der kleinen Teilchen.
- Parfümerie-Aufgabe
- Es gibt Wind und andere Luftbewegungen. Diese sorgen für eine Durchmischung des Parfümgeruchs mit der Luft. Daher kann die Diffusion nicht eindeutig beobachtet werden.
-
Ein Standzylinder mit braunem Bromgas und ein Standzylinder mit Luft werden verbunden. Dabei breitet sich die braune Farbe des Bromgases langsam im ganzen Raum der beiden Standzylinder aus. Dabei muss man jedoch unterscheiden ob sich das Bromgas im oberen oder im unteren Standzylinder befindet.
Ist das Bromgas im oberen Standzylinder so findet eine schnelle Durchmischung statt, da Bromgas eine höhere Dichte als Luft hat.
Ist das Bromgas im unteren Standzylinder findet trotz der höheren Dichte des Bromgases eine Durchmischung statt.
|
|
|
|
|
fester Schwefel |
flüssiger Schwefel |
gasförmiger Schwefel |
- Im festen Aggregatzustand hat jedes kleine Teilchen eine feste Position. Die kleinen Teilchen können sich nicht gegeneinander verschieben. Daher passt sich ein Salzkristall nicht der Form des Gefäßes an.
- Ein Gas kann man sehr gut komprimieren. Im Modell der kleinen Teilchen ist diese Tatsache am Abstand der kleinen Teilchen veranschaulicht. In der Gasflasche sind die kleinen Teilchen unter hohem Druck näher zusammen als im Luftballon. Daher kann man so viele Luftballone füllen.
- Kupfersulfat gehört zur Stoffklasse der salzartigen Stoffe. Kupfersulfat besitzt als typische Eigenschaften: Kupfersulfat ist spröde, die Lösung leitet den elektrischen Strom, löst sich gut in Wasser, hat eine hohe Schmelztemperatur (zersetzt sich vorher).
- In der Luft befindet sich gasförmiges Wasser. Dieses wird auch als Luftfeuchtigkeit bezeichnet. An einer kalten Flasche kondensiert das gasförmige Wasser zu flüssigem Wasser, es bilden sich kleine Wassertropfen.
-
Suspension: heterogenes Stoffgemisch von einem Feststoff in einer Flüssigkeit.
Emulsion: heterogenes Stoffgemisch von einer Flüssigkeit in einer Flüssigkeit.
Legierung: homogenes Stoffgemisch von mehreren Metallen. - Fachbegriffe von Stoffgemischen:
|
|
|
-
Feststoffe zusammen mit Wasser können unterschiedliche Eigenschaften haben:
a. 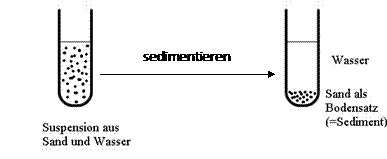

b. 

Eine Suspension ist ein heterogenes Stoffgemisch. Das bedeutet man kann die einzelnen Bestandteile (mit dem Mikroskop oder sogar dem bloßen Auge) erkennen. Eine Lösung ist ein homogenes Stoffgemisch. Man kann die einzelnen Bestandteile selbst mit einem Mikroskop nicht erkennen. c. Animationen „Filtration“ und FiltrationZ“ am Laptop. - Besprechung im Unterricht.
Stoffe und Eigenschaften:
Herunterladen
[doc]
[246 KB]
Stoffe und Eigenschaften:
Herunterladen
[pdf]
[443 KB]